在臺灣被稱作「漸凍症」的肌萎縮性脊髓側索硬化症(Amyotrophic Lateral Sclerosis, ALS),以及全球罹患人數僅次於阿茲海默症的額顳葉失智症(Frontotemporal Dementia, FTD),都是好發於中年人口的神經退化性疾病,致病原因迄今不明。中央研究院基因體研究中心陳韻如研究員團隊近期利用化學合成胜肽,首次發現並建立新毒理模型,同時也發現一種雙醣分子可增加腦神經細胞的存活率,減少神經元的退化,可望提供科學界更多神經退化性疾病的治療線索。研究成果已於今(2024)年2月23日發表於國際頂尖期刊《科學前緣》(Science Advances)。
中研院表示,漸凍症病患因脊髓、腦幹或大腦運動皮質區運動神經元的退化,造成全身肌肉漸進性萎縮與僵直,知名科學家史蒂芬‧霍金(Stephen William Hawking)就是與漸凍症搏鬥半個世紀。額顳葉失智症患者則因額顳葉神經元退化,特別在語言和社交行為上漸露病徵,如行為異常、語言障礙等,好萊塢動作巨星布魯斯威利(Bruce Willis)即因此息影。
陳韻如研究員長期深耕與蛋白質錯誤折疊相關的神經退化性疾病研究,她表示,儘管此二項疾病的臨床表現不同,卻共享相當多病理特徵和基因變異。臨床數據顯示,超過9成漸凍症以及約7成額顳葉失智症患者屬偶發型,不易分析與致病機轉有著密切關連性的基因變異來源。然而,家族性遺傳患者最常見的基因突變,皆來自C9ORF72基因中,DNA重複擴增GGGGCC(G4C2)序列的突變。
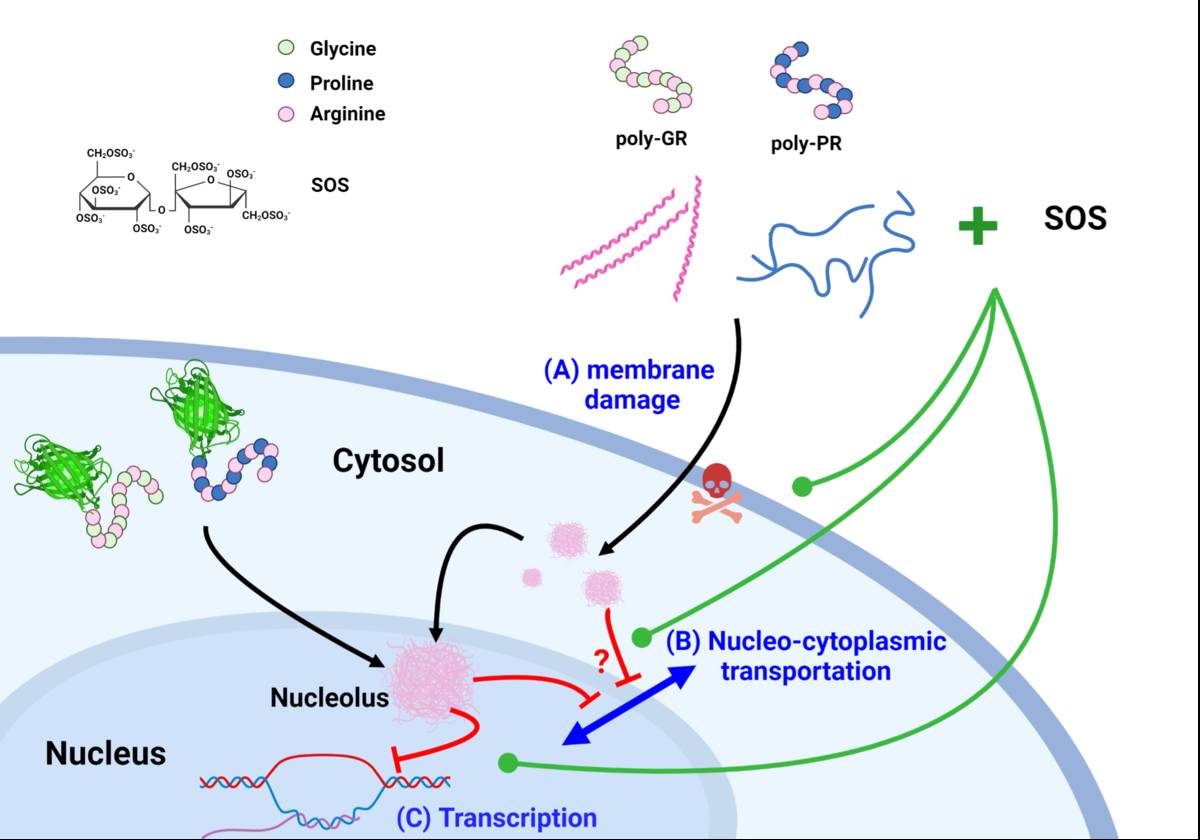
中研院說明,研究團隊首先以人工化學合成方法,製作出不同重複序列的poly-GR/-PR蛋白質,實驗證實,重複超過25-30次的poly-GR會降低神經細胞存活率,也會破壞細胞膜和核膜。本項研究更首次發現,藉由與核苷酸的交互作用,將使細胞內重要核苷酸機制如DNA複製、轉錄和蛋白質轉譯等皆無法運作。團隊另以細胞表達poly-GR/-PR進行實驗,也獲相同結果,這項致病機制首次獲得驗證,研究結果提供了存在於病患中G4C2重複次數的病理機制。
研究團隊進一步與國家同步幅射研究中心(National Synchrotron Radiation Research Center, NSRRC)鄭有舜研究員團隊合作,利用先進TPS13A 生物結構小角X光散射(SAXS)光束線,結合分子模擬,發現poly-GR蛋白質重複次數超過25-30次,才能形成軟螺旋的結構特徵。螺旋結構會破壞細胞膜,由此可證實特定長度的poly-GR才具有穿膜及細胞毒性。
由於神經細胞無法再生,提高細胞存活率是一種治療方向,研究團隊自基因體研究中心洪上程特聘研究員建置的硫酸乙醯肝素分子庫,篩選出一個硫酸雙醣分子(Sucrose Octasulfate, SOS),並作用於神經母瘤細胞、漸凍症病人多功能幹細胞分化的運動神經細胞,成功減緩由poly-GR/-PR所引發的神經毒性。此外,再於果蠅和小鼠實驗中,發現硫酸雙醣分子確可改善運動行為,驗證硫酸雙醣類的化合物可中和poly-GR/-PR毒性,為未來的漸凍症及額顳葉失智症治療策略提供新方向。
本研究由陳韻如指導,主要實驗由中研院跨領域神經科學國際研究生學程博士生張育仁完成;並與鄭有舜、洪上程、生物化學研究所姚季光副研究員、細胞與個體生物學研究所郭紘志研究員、臺北榮民總醫院神經醫學中心周邊神經科李宜中主任等協力合作。